Secciones
- Introducción
- Características del boro
- Principales productores mundiales
- Impacto del boro en el medio ambiente
- Tratamiento de efluente con boro
- Resumen
Introducción
El boro es un metaloide que se combina fácilmente en distintas formas debido a tener tres electrones libres en el último orbital, que le dan un carácter muy reactivo. Los compuestos de boro (del árabe buraq y este del persa burah) se conocen desde hace miles de años. En el antiguo Egipto, la momificación dependía del natrón, un mineral que contenía boratos y otras sales comunes.
En China se usaban ya cristales de bórax hacia el 300 a. C., y en la antigua Roma se utilizaban compuestos de boro en la fabricación de cristal. A partir del siglo VIII los boratos fueron usados en procesos de refinería de oro y plata.
En 1808 Humphry Davy, Gay-Lussac y L. J. Thenard obtuvieron boro con una pureza aproximada del 50% , aunque ninguno de ellos reconoció la sustancia como un nuevo elemento, cosa que haría Jöns Jacob Berzelius en 1824.
El boro puro fue producido por primera vez por el químico estadounidense W. Weintraub en 1909.
La importancia de los productos del boro se ve reflejada en la gran variedad de aplicaciones que poseen. Los principales usos de los boratos y compuestos de boro son: en la industria de esmaltes y cerámicas (sanitarios, vajillas, cerámicos, azulejos), industria del vidrio, cristales y fibras de vidrio, vidrios Pyrex para utensilios, lámparas y focos, detergentes y blanqueadores, retardadores del fuego, abrasivos, cosméticos, en la preservación de la madera, en capacitares, aleaciones, catálisis, caucho (ignífugo), cemento (disminuye la velocidad de fraguado), combustible (borano para aviones y cohetes), curtiembres (evita putrefacción), farmacia (antiséptico suave), pinturas (fungicida), aplicaciones nucleares, en óptica, etc. Además de estos usos industriales, el boro es uno de los 7 micronutrientes esenciales para las plantas, por lo que la dosificación del boro como fertilizante adquiere suma importancia.
El borofeno es uno de los materiales de moda. Hace unos 5-6 años, el grafeno parecía acaparar el interés mundial a nivel de materiales punteros para el desarrollo tecnológico pero actualmente el borofeno se postula como un gran candidato a quitarle el puesto, sobre todo en materia de nanotecnología.
El boro en la corteza terrestre
La concentración estimada del boro en la corteza terrestre es de 10 ppm, y su masa de 2,4 × 1017 kg.
Actualmente se sabe que el boro es mucho más abundante en rocas sedimentarias (300 ppm) que en rocas ígneas (3ppm), esta diferencia es consecuencia de cuatro características: el boro es sublimable, la no preferencia del boro por las fases fundidas (elemento incompatible), su alta movilidad en la fase acuosa y su fuerte afinidad por minerales arcillosos (elemento litófilo).
El boro llega a la corteza terrestre a través de diferentes vías, y éstas son la precipitación atmosférica, que contiene pequeñas cantidades de boro en disolución; y el vulcanismo y la actividad geológica análoga, que liberan roca fundida con concentraciones variables de boro.
También hay flujos del océano a la corteza oceánica en forma de sedimentación y diagénesis. Las vías de salida del boro curtical son la erosión y los procesos de subducción de placas.
El boro tiende a concentrarse en las fases residuales de la parte fundida, los elementos que componen la masa de magma solidifican en función de su punto de fusión y de su compatibilidad con la fase sólida, de esta forma, en los sucesivos estadios de la solidificación, la concentración de los elementos incompatibles (entre ellos el boro) va aumentando en el magma, hasta que finalmente tenemos un líquido formado por elementos incompatibles que acaban solidificándose.
Estos depósitos de elementos incompatibles son los que conocemos por el nombre de pegmatitas. Obedeciendo a este hecho las concentraciones del boro son relativamente bajas en basaltos (6-0,1 ppm) y más altas en rocas más cristalizadas como el granito (85 ppm) aunque también se encuentran altas concentraciones de boro en granitos derivados de rocas sedimentarias ricas en boro. Las pegmatitas pueden contener concentraciones de boro de 1360 ppm.
Durante el deterioro de rocas submarinas, las rocas ígneas se degradan y forman minerales arcillosos que adsorben boro del agua marina, de esta forma se enriquece en boro la masa de roca.
Los basaltos de las islas magmáticas tienden a estar enriquecidos en boro; este enriquecimiento se atribuye a la deshidratación de los bloques rocosos subducidos, ricos en boro adsorbido por minerales arcillosos.
Las fracciones ricas en boro toman parte en el proceso de fusión y las rocas volcánicas resultantes (andesitas y dioritas) están consecuentemente enriquecidas en boro. Minerales arcillosos (tales como ilitas, esmectitas y montmorillonitas) incorporan boro del agua tanto por adsorción como en forma de elemento de sustitución en la estructura.
Las rocas sedimentarias de los océanos tienden a contener más boro que las rocas sedimentarias fluviales ya que el agua marina contiene mayor concentración de boro que las aguas continentales.
El boro es adsorbido sólo a temperaturas inferiores a 40 °C, a más altas temperaturas (>150 °C) puede ser liberado del mineral, por ello, durante el metamorfismo de rocas sedimentarias mucho del boro adsorbido es liberado en el agua, y si se incrementa aún más el metamorfismo el boro como elemento sustituyente es también liberado, por lo tanto los sedimentos metamórficos tienden a contener concentraciones de boro ampliamente menores que las equivalentes rocas sedimentarias.
Los minerales principales en los que encontramos boro son en su mayoría rocas evaporíticas, como el bórax, altamente soluble en agua; la colemanita; la kernita (una forma parcialmente deshidratada del bórax) y la ulexita.
También existen importantes minerales del boro en forma de yacimientos de rocas ígneas, la datolita, el chorlo y la elbanita, estos minerales se clasifican en el grupo de los boratos (sales inorgánicas compuestas por boro y otros iones), exceptuando los dos últimos minerales mencionados, los cuales pertenecen al grupo de las turmalinas, que aparecen especialmente en filones del tipo pegmatítico.
El boro en la hidrosfera
El boro se encuentra en el agua marina en concentraciones estimadas en 4,6 ppm y en una masa de 5,4 × 1015 kg.
Lo hace como componente de dos moléculas hidratadas; el B(OH)3 trigonal y el B(OH)4- tetraédrico.
La proporción de las dos formas depende del pH del agua de mar y el equilibrio entre las concentraciones de las dos formas se encuentra en pH de 8,7-8,8, en medios más básicos predomina la forma tetraédrica y en medios más ácidos la trigonal.
Debido al gran tiempo de residencia del boro en el agua de mar (25 millones de años), las concentraciones de B(OH)3 y B(OH)4- no varían significativamente en los distintos océanos.
El boro llega a la hidrosfera desde los continentes mediante el ciclo del agua y por procesos de erosión de rocas, y desde la corteza oceánica por circulación hidrotermal, además también procede de la precipitación atmosférica.
El boro en la atmósfera
La atmósfera contiene unos 2,7 × 108 kg de boro. Este se encuentra en la troposfera en estado gaseoso en un 97%; el 3% restante se encuentra en estado sólido en forma de partículas.
Los tiempos de residencia que se consideran para el boro troposférico en su forma gaseosa son de 19 a 36 días, para el boro particulado son de 2 a 6 días. Debido a estos tiempos de residencia tan bajos las concentraciones de boro son variables en distintos puntos de la atmósfera.
El boro llega a la atmósfera a través de la evaporación del agua marina, entonces puede volver a los océanos o a los continentes por precipitación.
El boro en las plantas
Para las plantas el boro es un nutriente esencial. Parece tener un papel fundamental en el mantenimiento de la estructura de la pared celular (mediante formación de grupos cis-diol) y de las membranas.
Es un elemento poco móvil en el floema, por ello los síntomas de deficiencia suelen aparecer en las hojas jóvenes y los de toxicidad en las hojas maduras.
Un exceso de boro es perjudicial para algunas plantas poco tolerantes a este elemento, pudiendo actuar en sus nervaduras debilitándolas. En los manzanos y perales la deficiencia de boro se manifiesta en los frutos como una malformación interna.
Características del boro
Las principales características físicas y químicas del boro son las siguientes:
| Nombre, símbolo, número | Boro, B, 5 |
| Serie química | Metaloides |
| Grupo, período, bloque | 13, 2, p |
| Masa atómica | 10,811(7) u |
| Configuración electrónica | [He]2s22p1 |
| Dureza Mohs | 9,5 |
| Electrones por nivel | 2, 3 |
| Radio medio | 85 pm |
| Electronegatividad | 2,04 (escala de Pauling) |
| Radio atómico (calc) | 87 pm (radio de Bohr) |
| Radio covalente | 82 pm |
| Estado(s) de oxidación | 3 (levemente ácido) |
| Estado ordinario | Sólido (no magnético) |
| Densidad | 2460 kg/m3 |
| Punto de fusión | 2349 K (2076 ℃) |
| Punto de ebullición | 4200 K (3927 ℃) |
El boro presenta multitud de formas alotrópicas que tienen como elemento estructural común un icosaedro regular. La ordenación de los icosaedros puede ser de dos formas distintas:
- Unión de dos icosaedros por dos vértices, mediante enlaces covalentes normales B – B
- Unión de tres icosaedros por tres vértices, mediante un enlace de tres centros con dos electrones.
Dentro de estas posibles uniones, en el boro cristalino los icosaedros pueden asociarse de varias maneras para originar los alótropos correspondientes:
- Boro tetragonal (T – 50): formado por 50 átomos de boro por celdilla unidad, que son cuatro unidades icosaédricas unidas entre sí por algunos enlaces B – B y de dos boros elementales que actúan como unión tetraédrica entre icosaedros. Posee una densidad de 2,31 g/cm3.
- Boro romboédrico alfa (R – 12): está formado por láminas de icosaedros unidas paralelamente. Las uniones intralaminares se efectúan por medio de enlaces de tres centros, mientras que las uniones interlaminares se producen mediante enlaces de dos centros. La densidad de este tipo de boro es de 2,46 g/cm3, y presenta un color rojo claro.
- Boro romboédrico beta (R – 105): formado por doce icosaedros B12 ordenados en forma icosaédrica en torno a una unidad central de B12, es decir, B12(B12)12. Presenta una densidad de 2,35 g/cm3.
Isótopos del boro
En la naturaleza se encuentran dos isótopos de boro, 11B (80,1%) y 10B (19,9%).
Los resultados de sus masas se diferencian en una amplia gama de valores que se definen como la diferencia entre las fracciones 11B y 10B y tradicionalmente expresada en partes por mil, en aguas naturales que van desde -16 hasta 59.
Existen 13 isótopos conocidos de boro, el isótopo de más corta duración es 7B que se descompone a través de emisión de protones y la desintegración alfa.
Tiene una vida media de 3.5×10−22s. El fraccionamiento isotópico del boro es controlado por las reacciones de cambio de los compuestos especiales B(OH)3 y B(OH)4.
Los isótopos de boro también se fraccionan durante la cristalización de minerales, durante los cambios de fase de H2O en sistemas hidrotermales, y durante la alteración hidrotermal de rocas.
Principales productores mundiales
El boro origina diversos compuestos, desde óxidos simples a estructuras muy complejas de tipo polimérico.
Entre ellos se encuentran los óxidos denominados boratos. Los yacimientos de boratos de importancia comercial se localizan solamente en un reducido número de regiones geográficas en el mundo: Anatolia (Turquía), California y Nevada (suroeste de Estados Unidos), la Puna Sudamericana (sur de Perú, suroeste de Bolivia, norte de Chile y noroeste de Argentina), Inder (Rusia) y Asia Central (China y Rusia).
La Puna Sudamericana posee las terceras reservas mundiales de boratos, después de Turquía y la costa oeste de Estados Unidos.
Los yacimientos de la Puna Sudamericana producen preferentemente ulexita, tincal, colemanita e hidroboracita. Estos constituyen el mineral útil, de valor comercial, que se encuentra mezclado con otros materiales sin valor que constituyen la ganga, de los cuales debe ser separado.
La ulexita es un borato de sodio y calcio, poco soluble en agua fría, acompañado por ganga constituida por arenas, arcillas, yeso, calcita, todo impregnado en una salmuera compuesta principalmente por cloruros y sulfatos de sodio. Los boratos conocidos como “duros” (tincal, colemanita e hidroboracita) poseen ganga constituida por rocas (calcita, dragonita, arcilla, tobas, tufitas) e impurezas de hierro.
El tincal es un borato de sodio, soluble en agua, propiedad que se utiliza para separarlo de la ganga insoluble, y obtener posteriormente bórax mediante cristalización por enfriamiento. La colemanita es un borato de calcio con cinco moléculas de agua en su estructura y la hidroboracita es un borato de calcio y magnesio con seis moléculas de agua. Ambas tienen como impurezas principales hierro y arsénico.
Impacto del boro en el medio ambiente
Ni el boro ni los boratos son tóxicos para los seres humanos y animales. La DL50 para los animales es de unos 6 g por kg de peso corporal. Las sustancias con LD50 por encima de 2g se considera no tóxico.
La dosis mínima letal para los seres humanos no ha sido establecida, pero un consumo de 4 g/día se reportó sin incidentes, y las dosis clínicas de 20 g de ácido bórico para la terapia por captura de neutrones no causó problemas.
Algunos peces han sobrevivido durante 30 minutos en una solución saturada de ácido bórico y pueden sobrevivir más tiempo en soluciones de bórax. Los boratos son más tóxicos para los insectos que en los mamíferos.
El borano y algunos compuestos gaseosos similares son muy venenosos. No es un elemento que es intrínsecamente venenoso, pero su toxicidad depende de la estructura.
Los boranos (compuestos de boro de hidrógeno) son tóxicos, así como fácilmente inflamables y requieren cuidados especiales durante su manipulación. El borohidruro de sodio presenta un peligro de incendio debido a su carácter reductor, y la liberación de hidrógeno en contacto con el ácido. Los haluros de boro son corrosivos.
El boro en la salud humana
Científicamente no se ha demostrado que el boro sea una sustancia considerada esencial en la dieta humana o que sea un requerimiento dietario en vertebrados e invertebrados, o al menos de la misma importancia que ocupa en los vegetales.
El cuerpo humano contiene al menos 0.7 mg por kilo de peso de Boro obtenido del consumo de agua y vegetales. Un humano consume en su ingesta diaria unos 0.8 a 2.5 mg de boro por kilo de peso sin que se manifieste algún síntoma por esto.
Dietas forzadas de 5 g al día pueden causar náuseas, diarrea y vómitos; algunos autores sugieren que 20 g al día de boro puede ser mortal en organismos sensibles, pero no se ha comprobado.
Otras bibliografías parecen asociar la aparición de artritis por la ingesta de este elemento y otras publicaciones estiman que este elemento debe ser considerado a nivel de elemento esencial para el metabolismo de calcio, cobre, magnesio y la fijación de nitrógeno.
El boro puede ser tóxico para los vegetales, incluso con niveles bajos de concentración. Una concentración de boro inferior a 1 mg/l es esencial para el desarrollo de las plantas. La mayoría de las plantas muestran problemas de toxicidad cuando la concentración de boro excede los 2 mg/l.
La Organización Mundial de la Salud recomienda una concentración de boro en agua potable inferior a 0.5 mg/l. Los estándares de la UE requieren un nivel de boro inferior a 1 mg/l.
Tratamiento de efluentes con boro
El boro, debido a su naturaleza, no es fácil de eliminar de las matrices acuosas. Las técnicas clásicas de coagulación, sedimentación y aún por osmosis inversa no son satisfactorias.
Algunas experiencias han señalado que la aplicación de sistemas de resinas de intercambio iónico en conjunto con zeolitas y carbón activado son mucho más prometedoras como formas de reducir dicho elemento.
Tabla de tratamientos habituales de efluentes con boro
| Método | Concentración inicial boro | Eficacia | Proceso | Aplicación industrial | Costes relativos |
| Precipitación alcalina | Alta | Baja | Discontinuo | Baja | Muy bajos |
| Adsorción Me(OH)x | Alta | Muy alta | Discontinuo | Alta | Bajos |
| Adsorción sobre arcilla | Alta | Muy alta | Discontinuo | Media | Bajos |
| Intercambio iónico | Baja | Muy alta | Continuo (regeneración) | Alta | Altos |
| Extracción | Baja | Alta | Continuo | Baja | Altos |
| Ósmosis inversa | Baja | Alta | Continuo (limpieza) | Alta | Altos |
| Electrodiálisis | Baja | Alta | Continuo | Baja | Altos |
| Evaporación | Alta | Alta | Continuo | Media | Altos |
Las soluciones más utilizadas son: Ósmosis inversa, Intercambio iónico y el tratamiento de los efluentes con Evaporación.
La desalación por ósmosis inversa
La cantidad de boro en el agua de mar varía de 4 a 5.5 mg/L, proporcional a la salinidad. Proviene principalmente de la descarga de las plantas de tratamiento de agua residuales, en donde se comienza a utilizar jabones y detergentes, así como de los fertilizantes agrícolas.
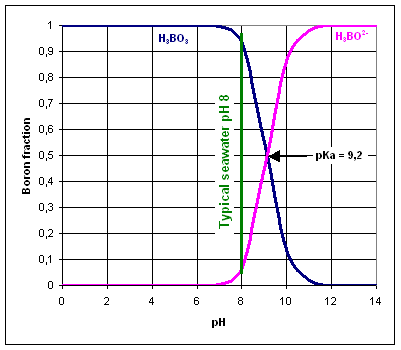
El boro está presente en el agua como ácido bórico H3BO3 y borato H3BO2-. La especie de boro predominante depende del pH del agua.
El valor pKa de H3BO3/H3BO2- es 9.2, por lo tanto, el equilibrio Está normalmente desplazado a la izquierda, ya que el valor de pH estándar del agua de mar es 8.
Las membranas de ósmosis inversa son muy eficientes en la eliminación de especies cargadas como el ion borato, en lugar de moléculas neutras como el ácido bórico.
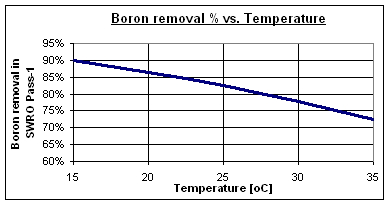
Las tasas típicas de eliminación de boro a pH 8 son entre 73 y 90% para membranas estándar de ósmosis inversa de agua de mar de alto rechazo, dependiendo de la temperatura del agua. Algunas membranas especiales de alta eliminación de boro pueden alcanzar valores de hasta 95%.
Normalmente el agua de mar de alta salinidad tiene alto contenido en boro y se encuentran en áreas con clima muy cálido, como el Golfo Persa, el Mar Rojo, el Mar Mediterráneo oriental y el Mar Caribe.
A 30 °C, la eliminación de boro se reduce al 78%, dejando 1.15 mg/l en la corriente de permeado del Paso-1. Por lo tanto, es necesario un proceso específico de eliminación de boro para alcanzar los 0.5 mg/l exigidos por la OMS.
Eliminación del boro del agua desalinizada
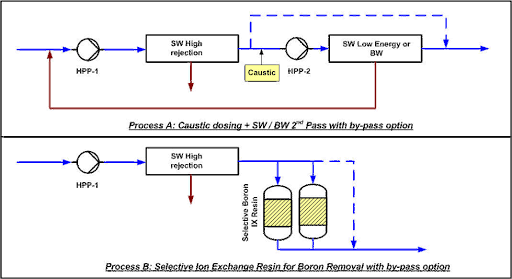
Existen dos procesos principales para producir agua potable con menos de 0.5 mg/L de boro, dependiendo de la salinidad del agua, la concentración de boro y la temperatura.
Proceso A: SWRO de 2 pasos:
En el paso-2 de ósmosis inversa se añade sosa caustica para subir el pH a 9.5. Parte del permeado del paso-1 puede ser bypaseado para mantener cierta cantidad de minerales en el agua. El segundo paso puede estar compuesto por membranas de agua de mar de baja energía si la temperatura y salinidad son elevadas o membranas de alto rechazo de agua salobre en caso de condiciones menos severas.
Proceso B: SWRO+ IX:
Se añade una resina de intercambio iónico con o sin bypass, dependiendo de la concentración de boro residual necesaria. La resina, que debe ser selectiva para el cloro, se regenera in-situ con sosa caustica y ácido clorhídrico. Para que la producción sea de forma continua, es necesario un sistema de doble columna.
El sistema de tratamiento de eliminación de boro por ion selectivo permite eliminar de cualquier agua, el exceso de este elemento, que, en determinados cultivos (fundamentalmente frutales de hueso o de pepita), su alta concentración puede llegar a ser tóxica o dañina para la plantación.
Esta toxicidad puede tener mayor incidencia, cuando se utilizan aguas residuales para el riego, o subterráneas contaminadas por estas últimas.
El influente atraviesa la resina de intercambio iónico, especialmente diseñada para la eliminación del boro en soluciones acuosas, con lo que a la salida se obtiene un agua con una reducción de boro del 90%.
La capacidad de intercambio está limitada y cuando la resina ha llegado a su agotamiento se efectúa su regeneración.
La regeneración de las resinas está totalmente automatizada y se efectúa mediante el paso de una determinada concentración de ácido a través del lecho de resinas, eliminando de estas el boro retenido, posibilitando el almacenaje de la solución acuosa de la regeneración, de forma que se pueda gestionar como residuo posteriormente.
Los efluentes ricos en boro procedentes de las resinas o membranas de osmosis inversa se pueden concentrar hasta valores que permitan su recuperación, mediante técnicas de evaporación a vacío. Condorchem – Envitech tiene capacidad para ofrecer soluciones integrales para esta aplicación.
Resumen
El boro es un elemento químico muy reactivo que aparece en la naturaleza combinado en diversas formas. Tiene múltiples aplicaciones industriales y un futuro importante en base a la aparición del borofeno, como sucesor del grafeno, cuyas propiedades lo hacen firme candidato para aplicaciones nanotecnológicas.
Pese a ser necesario para la vida de las plantas, y ser bien tolerado por los seres humanos y los animales, existen límites que no deben superarse para que no resulte nocivo.
Una de las soluciones técnicas que se viene utilizando desde hace muchos años para combatir la sequía, es la desalación por ósmosis inversa, pero el concentrado es rico en este elemento y además el agua desalada se suele quedar por encima de las 0,5 ppm establecidas como límite máximo por la OMS, lo que requiere de tratameintos complementarios que separan más boro.
Así las opciones consisten en hacer pasar el permeado por un segundo paso de ósmosis inversa, o bien por un lecho de resinas específicas. En el caso de las resinas se elimina la práctica totalidad del boro presente.
En ambos casos queda un concentrado que podrá ser recuperado previa concentración en un sistema de evaporación a vacío, en que Condorchem, – Envitec tiene probada experiencia.
Referencias bibliográficas y en Internet
http://oa.upm.es/155/1/05200006.pdf
https://rua.ua.es/dspace/bitstream/10045/13838/1/Tesis_Chillon.pdfçç