SECCIONES
- Introducción
- Procesos pal y caron
- Proceso sherrit-gordon
- Proceso cloruración níquel
- Extracción por formación de quelatos
Introducción
El Cobalto y el Níquel se encuentran asociados mutuamente en la Naturaleza en gran número de yacimientos. La minería de estos metales, junto con otros tecnológicamente asociados a los avances electrónicos y especialmente en el campo de las baterías, la acumulación de energía y la disminución del volumen de estos elementos indispensables en nuestros móviles, ordenadores, los vehículos híbridos, los vehículos eléctricos, está volviéndose a activar para garantizar suministros crecientes. El precio internacional del cobalto se disparó un 127% en 2017, el del cobre 30%, el del wolframio 27%, el precio del litio casi se ha doblado desde 2015 y a estos indicadores es importante observar como determinados países van tomando posición física en determinados yacimientos, como la China en Katanga. Los procesos asociados a estos tratamientos extractivos han de evolucionar y a partir de optimizadas tecnologías hacer frente a los yacimientos con leyes inferiores. El cobalto y el níquel son dos elementos que toman posición en las nuevas tecnologías, especialmente en las que tienen una vinculación energética.
El cobalto forma parte de superaleaciones de aceros que deben trabajar a alta temperatura y resistir procesos de desgaste por fluencia, imanes (Alnico, Fernico, Cunico..), esmaltes , recubrimientos, electrodos, baterías, cables de estructura para neumáticos. Los minerales más importantes del cobalto son la esmaltita CoAs2 y la cobaltita CoAsS, pero desde un punto de vista técnico las principales fuentes de cobalto son los “speiss”. Estos materiales son una mezcla de arseniuros que contienen cantidades apreciables de níquel, cobalto, hierro o plata. Las principales reservas de cobalto están situadas en Congo, Rusia, Perú, Canadá, Finlandia, Chile, Birmania, Marruecos y Zimbaue. Normalmente el Arsénico también forma partes de los minerales de constitución.. El tratamiento inicial de estos arseniuros se produce mediante un triturado y concentrado por flotación o gravedad. Las partes enriquecidas en níquel, cobalto y a menudo también incluyen el hierro, son mezcladas con coque metalúrgico. Este coque se obtiene a partir del carbón bituminoso en hornos con atmósfera libre de oxígeno, retirando el contenido volátil y obteniéndose un carbón poroso apto para estos tratamientos metalúrgicos. La mezcla de la mena se realiza con óxido de calcio y sílice, produciendo una escoria. Este hecho permite separar la plata, una mezcla de materiales ricos en cobre, níquel y cobalto y un residuo escorificable. Esta mezcla rica en cobre, níquel y cobalto es lo que técnicamente se llama “speiss”. El recorrido de esta mezcla al estado puro del metal es un proceso complejo.
El níquel se encuentra en la Naturaleza normalmente combinado con el arsénico, el antimonio y el azufre como sulfuro. De forma aproximada el 65% de níquel se utiliza en la fabricación de acero inoxidable austenítico y otro 21% en la fabricación de superaleaciones. El resto se utiliza para la fabricación de otras aleaciones (Alnico, mu-metales, monel, nitinol) y catalizadores. Canadá, Cuba y Rusia producen el 70% del níquel en el mundo. Bolivia, Colombia y Nueva Caledonia tienen también importantes yacimientos. Los minerales fuentes de níquel son la millerita, NiS, aunque también hay depósitos de NiSb, NiAs2, NiAsS o NiSbS y la garnierita Si4O13[Ni, Mg]2•2 H2O. Los depósitos más importantes desde un punto de vista comercial son los de garnierita, que es un silicato de magnesio y níquel de composición variable y combinado con la pirrotina (FenSn+1) que contiene de un 3 al 5 % de níquel. También se encuentra níquel procedente de meteoros aleado con el hierro.
PROCESOS PAL Y CARON
En general el tratamiento de níquel se basa en tratar los sulfuros de níquel mediante una tostación al aire para obtener el NiO. Este se reduce con carbón para obtener níquel metálico. La purificación del níquel se procede mediante el monóxido de carbono que se combina con el níquel impuro a 50ºC y presión atmosférica o con la mezcla de níquel y cobre , en condiciones más complejas, obteniéndose el Ni(CO)4, que es volátil. Por descomposición térmica a 200ºC se recupera el níquel puro con una elevada pureza.
Cuando se habla de la metalurgia del níquel y cobalto, se ha de diferenciar diferentes tipos de yacimientos. En primer lugar los yacimientos lateríticos limoníticos. Son suelos situados en regiones cálidas que se caracterizan por baja concentración de sílice y un alto contenido en óxidos. Estos materiales se tratan habitualmente con métodos hidrometalúrgicos; proceso CARON (lixiviación generada por carbonato de amonio) y proceso PAL (lixiviación ácida de alta presión). El proceso metalúrgico PAL implica el precalentamiento del mineral y la lixiviación con ácido sulfúrico concentrado a altas temperaturas y presiones. Las especies químicas de níquel y cobalto mediante proceso químico hidrometalúrgico en sales de sulfato solubles, y se recuperan de la disolución en un circuito de decantación a contracorriente (CCD). El CCD implica lavar el residuo y recuperar el níquel y el cobalto solubles. El ácido restante se neutraliza usando una suspensión de carbonato cálcico, que produce un precipitado de sulfato de calcio. Se puede inyectar sulfuro de hidrógeno para precipitar níquel y otros sulfuros. A partir de esto, hay una lixiviación posterior para eliminar el hierro y el cobre, y finalmente la precipitación de níquel mediante la adición de amoníaco, sulfato de amonio e hidrógeno. Uno de los procesos más utilizado para tratar “speiss” de níquel y cobalto es el proceso Sherrit-Gordon Mines Ltd. de Fort Saskatchewan Alberta, Canadá.
PROCESO SHERRIT-GORDON
Los procesos de la metalurgia de Níquel y el Cobalto empiezan con el tratamiento inicial del mineral, reconcentrándolo a través del triturado y la flotación/gravedad y obteniendo un “speiss”, rico en cobalto y níquel. El proceso empieza introduciendo el mineral asociado básicamente a sulfuro, en un reactor con ácido sulfúrico y aire a presión. En este procedimiento se eliminan los sulfuros obteniendo sulfato de níquel (II) y sulfato e cobalto (II) en disolución. En esta primera etapa de disolución se elimina el sulfuro.
NiS + 2O2 ⟶ NiSO4
CoS + 2O2 ⟶ CoSO4
El proceso de lixiviación tiene lugar con NH3, se ajusta el pH y se produce una primera precipitación del hierro.
NH3 + H2O ⟶ NH4OH
Fe+3 + OH ⟶ Fe(OH)3
Se produce la precipitación del Fe3+ en forma de Fe2O3 y del SiO2. El hierro, habitualmente va asociado a los sulfuros de cobalto y níquel y es preciso separarlo. Regulando el pH a valores cercanos a 7, se produce su deposición. Posteriormente en las mismas condiciones de aires a presión y amoniaco, se produce la oxidación de Co2+ a Co3+.
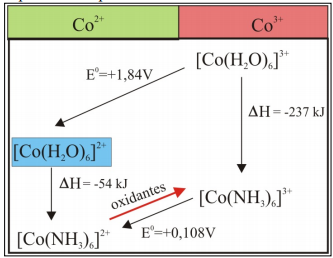
Las disoluciones de cobalto (II) en disolución acuosa y presencia de amoniaco se oxidan fácilmente a Co (III) con formación de complejos. La mayoría de agentes formadores de complejos son ligandos que provienen de ácidos débiles, es decir bases de Brönsted y por tanto el valor del pH es un factor crítico para la formación y estabilización del complejo. La concentración efectiva de ligando en la disolución, que viene determinado por el pH, afectará a la disolución del complejo. En general a valores de pH alto, la disociación del complejo es menor, pues a esos valores de pH predomina el ligando libre.
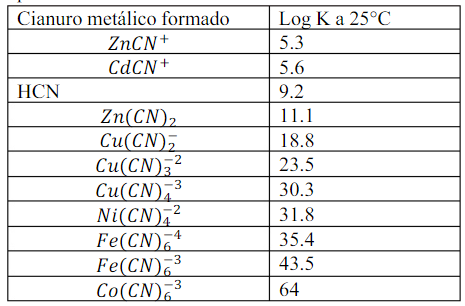
Sin embargo, por un lado, la oxidación del Co(II) a Co(III) no es fácil ya que los compuestos de Co(II) son mucho más estables y por otra los compuestos de coordinación del Co(III) intercambian difícilmente los ligandos a diferencia de los de Co(II), por ello en la química a la gota que requiere un tiempo y no se puede aportar energía calorífica al sistema, casi siempre se obtiene una mezcla de los dos complejos, los de Co(II) y los de Co(III).Por este motivo el reactor se lleva a temperaturas de 80ºC y presiones de aire de 9 atmosferas. La explicación se puede hacer considerando los datos de la siguiente tabla;
En esta parte del proceso de lixiviación es preciso el aporte de temperatura, para la formación del [Co(NH3)6]3+.
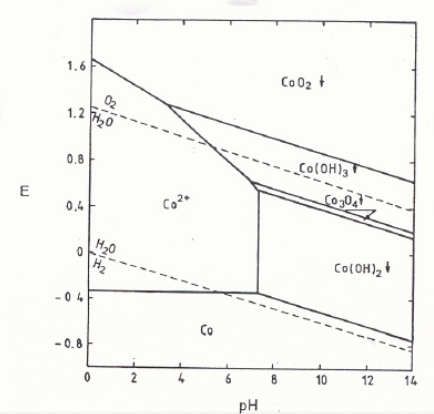
La formación del Co3+, según indica el diagrama de Pourbaix, esta favorecida por pH básicos y potenciales superiores a 1.2.
En el siguiente paso se añade ácido sulfúrico de forma que se produce el sulfato de níquel y amonio( NiSO4 (NH4)2SO4.H2O ). Esta sal tiene una coloración verde y es poco soluble en aguade forma que se favorece la precipitación. En este paso se procede a evaporar y cristalizar esta sal, de forma repetida para aumentar la pureza de los cristales. Estos cristales de sulfato doble de níquel y amonio son tratados con una solución concentrada de NaOH, de forma que se obtiene Ni (OH)2. El hidróxido de níquel se disuelve con ácido sulfúrico y se obtiene sulfato de níquel, que por electrólisis permite la reducción del Ni2+ a Ni0. Las disoluciones de sulfato de amonio permiten la recuperación del amoniaco por stripping.
Finalmente la disolución liquida que contiene [Co (NH3)6]3+, es reducida de Co3+ a Co2+, mediante polvos de Co0 (cobalto metálico). Finalmente, mediante hidrógeno se produce la reducción del Co2+ a Co0. Obteniéndose polvo de cobalto metálico.
A continuación se expone un diagrama con la secuenciación de las diferentes operaciones del proceso Sherrit-Gordon.
PROCESO CLORURACIÓN NÍQUEL
En la actualidad las grandes menas de cobalto y níquel están en proceso de franco agotamiento y las principales menas de estos dos metales están constituidas por leyes menores y concentraciones minerales formadas por diferentes metales. Esto obliga en cada acaso a modificar los procesos extractivos de tratamiento del mineral.
En este sentido, en el caso de “speiss” de cobalto y niquel con baja ley se procede con tratamiento en medio clorado;
Co2+ + Cl2 + ZnO (pH4; regulador de pH) ⟶ Co3+
Ni2++ Cl2 + ZnO (pH4; regulador de pH) ⟶Ni3+
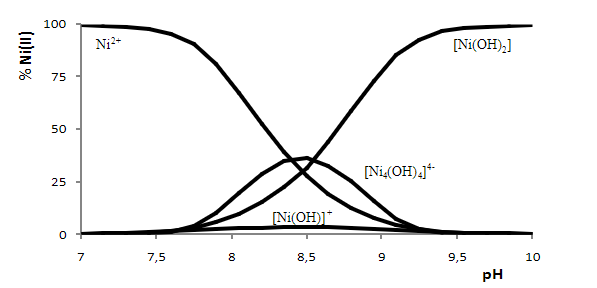
Controlando adecuadamente el pH i el potencial de reducción, especialmente a pH básico de acuerdo al diagrama de distribución de especies químicas, el Ni(II) se puede mantener en disolución y precipitar el Co(OH)3:
Mediante calcinación se puede transformar el hidróxido de cobalto en óxido de cobalto. Este óxido de cobalto (III) puede estar impurificado con óxido de zinc, por lo cual deberá ser tratado a un pH débilmente ácido y separado convenientemente del cobalto. Finalmente el hidróxido de cobalto puede ser transformado por calcinación el óxido de cobalto (III).
EXTRACCIÓN POR FORMACIÓN DE QUELATOS
Otro de los métodos más utilizados para el tratamiento de mezclas metálicas concentradas es el tratamiento con agestes extractantes. En este proceso se trata una disolución concentrada por lixiviación ácida (ácido sulfúrico) en especies como el níquel, cobre y hierro. En primer lugar se trata la elevada concentración de ácido sulfúrico con amina, con objeto de reducir su concentración. En una segunda fase, se produce el tratamiento de ajuste de pH a un valor entre 3 y 4 que facilita el precipitado de hierro. En disolución se mantiene el cobre y el níquel. Mediante solvente extraemos el cobre. Los tipos de solvente utilizados en este proceso son substancias orgánicas como las oximas, el dietilditiocarbamato, butilacetatos, cetoximas…). Estos solventes forman quelatos con la especie metálica en cuestión, en este caso el cobre, y permite su paso a la fase orgánica formando un compuesto organometálico.
La fase acuosa se enriquece con NaCN con objeto de facilitar la formación de complejos del níquel en la fase acuosa y acentuar la diferencia entre las dos fases, de forma que las dos especies queden estabilizadas en sus fases respectivas.
Una vez separadas las disoluciones de níquel y cobre, se pueden recuperar los metales por recuperación electrolítica.
BIBLIOGRAFIA
Cheng S., Gattrell M., Guenat T., MacDougall B. The electrochemical oxidation of alkaline cooper cyanide solutions. Electrochimica Acta 47 (2002) 3245-3256.
Cornwall, H. (1966). Nickel Deposits of North America. [ebook] Washington: United States Government Printing Office. Available at: https://pubs.usgs.gov/bul/1223/report.pdf [Accessed 31 July 2017].
Crundwell, F, Moats, M, Ramachandran, V, Robinson, T, & Davenport, WG 2011, Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals, Elsevier Science, Oxford. Available from: ProQuest Ebook Central. [31 July 2017].
Kumar, V., Sahu, S. and Pandey, B. (2010). Prospects for solvent extraction processes in the Indian context for the recovery of base metals. A review.Hydrometallurgy, 103(1-4), pp.45-53.
Jeffrey M.I., Linda L.,. Breuer P.L, Chu C.K. A kinetic and electrochemical study of the ammonia cyanide process for leaching gold in solutions containing copper. Minerals Engineering 15 (2002) 1173–1180
Ones, J. (2017). Nickel Powders from the Carbonyl Process. [online] AZoM.com. Available at: https://www.azom.com/article.aspx?ArticleID=499 [Accessed 31 July 2017].