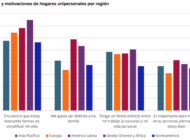
 Tratamiento de efluentes de la industria cosméticaAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria cosmética.
Tratamiento de efluentes de la industria cosméticaAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria cosmética.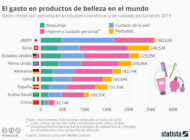 Tratamiento de efluentes de la industria de perfumes y esenciasAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria del perfume y esencias.
Tratamiento de efluentes de la industria de perfumes y esenciasAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria del perfume y esencias.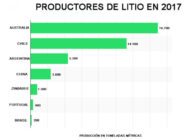 Extracción y recuperación de litio y reciclaje de bateríasAnalizamos cómo se extrae y recupera el litio y vemos las diferentes alternativas para el reciclaje de baterías de ion litio.
Extracción y recuperación de litio y reciclaje de bateríasAnalizamos cómo se extrae y recupera el litio y vemos las diferentes alternativas para el reciclaje de baterías de ion litio.

