Ingeniería ambiental para el sector industrial
Puedes buscar artículos por categoría
O puedes buscarlos por palabra clave
Últimos artículos
 Tratamiento de efluentes de la industria cosméticaAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria cosmética.
Tratamiento de efluentes de la industria cosméticaAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria cosmética.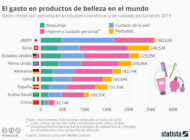 Tratamiento de efluentes de la industria de perfumes y esenciasAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria del perfume y esencias.
Tratamiento de efluentes de la industria de perfumes y esenciasAnalizamos las caracterísiticas, mercado, principales compuestos usados y tratamiento de los efluentes en la industria del perfume y esencias.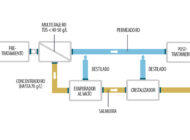 Tratamiento de aguas residuales generadas en explotaciones minerasRepasamos las alternativas que hay en el mercado para reutilizar o descargar agua limpia en los procesos de las explotaciones mineras.
Tratamiento de aguas residuales generadas en explotaciones minerasRepasamos las alternativas que hay en el mercado para reutilizar o descargar agua limpia en los procesos de las explotaciones mineras. Extracción y refinado de litio mediante cristalizaciónRevisamos a fondo la extracción, cristalización y obtención de compuestos de litio, así como otros aspectos de la minería del litio.
Extracción y refinado de litio mediante cristalizaciónRevisamos a fondo la extracción, cristalización y obtención de compuestos de litio, así como otros aspectos de la minería del litio. Acondicionamiento de residuos nucleares de baja y media actividadRevisamos la situación actual, el acondicionamiento y tipología de los residuos nucleares de baja y media actividad generados en centrales nucleares.
Acondicionamiento de residuos nucleares de baja y media actividadRevisamos la situación actual, el acondicionamiento y tipología de los residuos nucleares de baja y media actividad generados en centrales nucleares.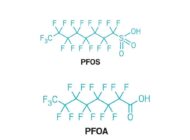 Tratamiento de efluentes con PFASDetallamos cómo tratar aguas residuales que contienen las sustancias perfluoroalquiladas (PFAS) así como sus efectos sobre la salud y el medio ambiente.
Tratamiento de efluentes con PFASDetallamos cómo tratar aguas residuales que contienen las sustancias perfluoroalquiladas (PFAS) así como sus efectos sobre la salud y el medio ambiente. Tratamiento de aguas residuales en la industria del vinoAnálisis de los efluentes generados en la producción de vino en bodegas y de las soluciones en el tratamiento de aguas residuales en la industria vinícola.
Tratamiento de aguas residuales en la industria del vinoAnálisis de los efluentes generados en la producción de vino en bodegas y de las soluciones en el tratamiento de aguas residuales en la industria vinícola. Tratamiento de aguas residuales de la industria lácteaEn este artículo revisamos el proceso de producción de la industria láctea, los vertidos que genera y las diferentes opciones de tratamiento de efluentes.
Tratamiento de aguas residuales de la industria lácteaEn este artículo revisamos el proceso de producción de la industria láctea, los vertidos que genera y las diferentes opciones de tratamiento de efluentes.