Ingeniería ambiental para el sector industrial
Puedes buscar artículos por categoría
O puedes buscarlos por palabra clave
Últimos artículos
 Tratamiento de efluentes en la industria cervecera y valorización de sus residuos líquidosTratamiento de aguas residuales mediante procesos biológicos en la industria cervecera y valorización de sus residuos mediante evaporación al vacío.
Tratamiento de efluentes en la industria cervecera y valorización de sus residuos líquidosTratamiento de aguas residuales mediante procesos biológicos en la industria cervecera y valorización de sus residuos mediante evaporación al vacío.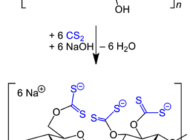 Tratamiento de aguas residuales procedentes de la fabricación de celofánComposición del celofán, principales aplicaciones, proceso de fabricación, aguas residuales que genera y opciones para el tratamiento de efluentes.
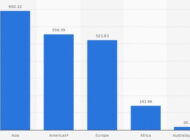
Tratamiento de aguas residuales procedentes de la fabricación de celofánComposición del celofán, principales aplicaciones, proceso de fabricación, aguas residuales que genera y opciones para el tratamiento de efluentes.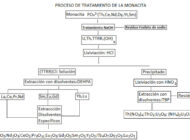 Métodos para la extracción de minerales con tierras RarasAnalizamos distintos métodos y tecnologías para la extracción de minerales con tierras raras y su uso en distintos procesos productivos.
Métodos para la extracción de minerales con tierras RarasAnalizamos distintos métodos y tecnologías para la extracción de minerales con tierras raras y su uso en distintos procesos productivos.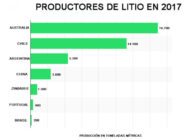 Extracción y recuperación de litio y reciclaje de bateríasAnalizamos cómo se extrae y recupera el litio y vemos las diferentes alternativas para el reciclaje de baterías de ion litio.
Extracción y recuperación de litio y reciclaje de bateríasAnalizamos cómo se extrae y recupera el litio y vemos las diferentes alternativas para el reciclaje de baterías de ion litio. Obtención de agua ultrapura por electrodesionizaciónLa electrodeionización (EDI) es una tecnología que combina dos tecnologías de purificación, electrodiálisis e intercambio de iones para producir agua ultrapura.
Obtención de agua ultrapura por electrodesionizaciónLa electrodeionización (EDI) es una tecnología que combina dos tecnologías de purificación, electrodiálisis e intercambio de iones para producir agua ultrapura. Tratamiento de aguas residuales en fábricas de pescado y mariscoAnalizamos las soluciones y tecnologías para el tratamiento de aguas residuales y efluentes generados en la industria del pescado, marisco y conservas.
Tratamiento de aguas residuales en fábricas de pescado y mariscoAnalizamos las soluciones y tecnologías para el tratamiento de aguas residuales y efluentes generados en la industria del pescado, marisco y conservas. Tratamiento de efluentes con DQO refractariaLos efluentes, o aguas, con DQO refractaria no pueden ser tratados con procesos biológicos. La oxidación húmeda es la solución más eficiente a día de hoy.
Tratamiento de efluentes con DQO refractariaLos efluentes, o aguas, con DQO refractaria no pueden ser tratados con procesos biológicos. La oxidación húmeda es la solución más eficiente a día de hoy. Tratamiento de aguas con tritio proveniente de reactores en centrales nuclearesAnalizamos la problemática de las aguas con tritio provenientes de reactores de centrales nucleares y las posibles soluciones para su tratamiento.
Tratamiento de aguas con tritio proveniente de reactores en centrales nuclearesAnalizamos la problemática de las aguas con tritio provenientes de reactores de centrales nucleares y las posibles soluciones para su tratamiento.

